Ce este caldura izobarice 1
Energia internă a organismelor
Potrivit MKT toate substanțele constau din particule care sunt în mișcare termică continuă și interacționează unele cu altele. Prin urmare, chiar dacă organismul este staționar și are de la zero energie potențială are energie (energie internă), care este energia totală a mișcării și interacțiunea microparticulelor care constituie corpul. Structura energiei interne include:
- energia cinetică a translațională, mișcarea de rotație și vibrație a moleculelor;
- energia potențială a interacțiunii dintre atomi și molecule;
- în termen de atom și a energiei nucleare.
În termodinamică consideră procesele la temperaturi la care nici o mișcare oscilatorie este excitat atomii în molecule, adică, la temperaturi care nu depășesc 1000 K. numai primele două componente ale schimbării în energie internă a acestor procese. prin urmare
sub energie internă în termodinamică înțeleagă suma energiei cinetice a moleculelor și atomilor corpului și energia potențială a interacțiunii lor.
Energia internă a corpului determină starea termică și se schimbă în timpul tranziției de la un stat la altul. În această stare, corpul are o energie internă bine definită nu depinde de faptul dacă, ca urmare a procesului, transformat în această stare. Prin urmare, energia internă este adesea menționată ca o funcție de starea organismului.
Calculați energia internă doar pentru un gaz ideal, deoarece Moleculele nu interacționează unul cu altul și energia lor potențială este egală cu zero:
U = \ dfrac \ cdot \ dfrac \ cdot R \ cdot T \)
unde i - gradul de libertate. Pentru un gaz monoatomic (de exemplu, gaz inert) i = 3 pentru dihidric - i = 5.
Se observă din aceste formule că energia internă a unui gaz ideal depinde numai de temperatura și numărul de molecule și este independent de volumul sau presiunea. Prin urmare, variația energiei interne a unui gaz ideal este determinată de doar o modificare a temperaturii sale și este independentă de natura procesului, în care gazul trece de la o stare la alta:
\ Delta U = U_2 - U_1 = \ dfrac \ cdot \ dfrac \ cdot R \ cdot \ Delta T \)
- moleculele de gaz reale interacționează unele cu altele și, prin urmare, au potențialul energetic wp. care depinde de distanța dintre moleculele și, prin urmare, volumul ocupat de gaz. Astfel, energia internă a gazului real, depinde de temperatură, volumul și structura moleculelor.
* Derivarea
Energia cinetică medie a moleculei \ (
\ Stânga \ Langle W_k \ dreapta \ rangle = \ dfrac \ cdot k \ cdot T \).
Numărul de molecule dintr-un gaz \ (
N = \ dfrac \ cdot N_A \).
Prin urmare, energia internă a unui gaz ideal
U = N \ cdot \ stângă \ Langle W_k \ dreapta \ rangle = \ dfrac \ cdot N_A \ cdot \ dfrac \ cdot k \ cdot T. \)
Având în vedere că k⋅NA = R - constanta universală a gazelor, avem
U = \ dfrac \ cdot \ dfrac \ cdot R \ cdot T \) - energia internă a unui gaz ideal.
Modificarea internă a energiei
În scopul de a rezolva problemele practice joacă un rol important nu energia internă și schimbarea acestuia U2 = DU - U1. Schimbarea în energie internă este calculată din legea de conservare a energiei.
Energia internă a corpului poate fi schimbat în două moduri:
- Atunci când se efectuează un lucru mecanic. a) Dacă forța externă determină deformarea corpului, în care schimbarea distanței dintre particulele din care este compus, și deci variază energia potențială a particulelor de interacțiune. Când deformații inelastice, în plus, temperatura corpului variază, adică, schimbarea energia cinetică a mișcării termice a particulelor. Dar lucrarea se face la deformarea corpului, care este o măsură a schimbării în energie internă a corpului. b) energia corpului interior variază, de asemenea, cu ciocnirea inelastică cu un alt organism. Așa cum am văzut mai înainte, energia cinetică într-o coliziune neelastică corpurilor este redus, acesta este convertit în interior (de exemplu, dacă te-a lovit de câteva ori cu un ciocan pe un fir întins pe nicovală - firul se încălzește). O măsură de schimbare în energia cinetică a corpului este, în conformitate cu teorema energiei cinetice, activitatea forțelor care acționează. Acest lucru poate servi ca o măsură a modificării energiei interne. c) energia internă a schimbării a corpului are loc sub influența forțelor de frecare așa cum este cunoscut din experiență, frecare este întotdeauna însoțită de o modificare a temperaturii organelor de fricțiune. frecare de lucru forță poate servi ca o măsură a modificării energiei interne.
- Cu ajutorul căldurii. De exemplu, în cazul în care organismul este plasat în flacăra arzătorului, modificarea temperaturii, prin urmare, schimbarea și energia sa internă. Cu toate acestea, nici o lucrare nu este efectuată, pentru nici o mișcare vizibilă fie a corpului sau a părților acestuia.
Schimbarea în energie internă a sistemului fără loc de muncă numit schimb de căldură (transfer de căldură).
Există trei tipuri de transfer de căldură: conducție, convecție și radiație.
a) conducta de căldură se numește procesul de transfer de căldură între corpurile (sau părți ale corpului) la contactul lor direct cauzate de mișcarea termică aleatoare a particulelor în organism. Amplitudinea oscilației unui corp rigid al moleculelor este mai mare, cu atât mai mare temperatura. Conductivitatea termică a gazelor datorită schimbului de energie dintre moleculele de gaz in ciocniri. ambele mecanisme funcționează în cazul lichidelor. Conductivitatea termică a substanțelor solide maxime și minime în stare gazoasă.
b) transfer de căldură prin convecție este curge un lichid sau gaz încălzite din porțiuni univolume ocupate de acestea în altele.
c) în transferul de căldură prin radiație se realizează la o distanță, prin intermediul undelor electromagnetice.
Luați în considerare în mai multe detalii privind modul de schimbare a energiei interne.
lucru mecanic
Atunci când se analizează procesele termodinamice de mișcare mecanică a corpurilor macroscopice nu este considerată ca un întreg. Conceptul de lucru este asociat cu o modificare a volumului corpului, adică, piese macrobody se deplasează în raport cu celălalt. Acest proces conduce la o modificare a distanței dintre particule, și, de asemenea, de multe ori pentru a modifica viteza mișcării lor, prin urmare, o modificare a energiei interne a corpului.
proces izobară
Să considerăm mai întâi un proces izobară. Să presupunem că într-un cilindru cu un piston mobil este un gaz la temperatura T1 (Fig. 1).
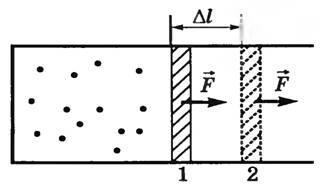
Ne încălzește încet gazul la o temperatură T2. Isobarically gaz se va extinde, iar mișcarea pistonului din poziția 1 în poziția 2 printr-o distanță Δl. Forța de presiune a gazului, astfel, nu funcționează pe organisme externe. Deoarece p = const, atunci forța de presiune F = p⋅S de asemenea constant. Prin urmare, activitatea acestei forțe poate fi calculat prin formula
A = F \ cdot \ Delta l = p \ cdot S \ cdot \ Delta l = p \ cdot \ Delta V \)
în cazul în care Av - modificarea volumului de gaz.
- În cazul în care volumul de gaz nu se schimbă (proces izocoră), gazul de operare este zero.
- Munca de gaze numai în procesul de schimbare a volumului său.
La expansiune (Av> 0) se face cu gaz pozitiv de lucru (A> 0); Compresiv (Av <0) газа совершается отрицательная работа (А <0).
- Dacă luăm în considerare funcționarea forțelor externe A „(A“ = -A), apoi expansiunea (Av> 0) de gaz A ' <0); при сжатии (ΔV <0) А '> 0.
Ecuația lui Mendeleev-Clapeyron gaz pentru două stări:
p \ cdot V_1 = \ Nu \ cdot R \ cdot T_1, \; \; p \ cdot V_2 = \ Nu \ cdot R \ cdot T_2, \)
p \ cdot (V_2 - V_1) = \ Nu \ cdot R \ cdot (T_2 - T_1) \).
Prin urmare, atunci când procesul de izobară
A = \ Nu \ cdot R \ cdot \ Delta T. \)
Dacă ν = 1 mol, când ΔΤ = 1 Pentru a obține că R este numeric egal cu A.
Prin urmare, sensul fizic al constanta universală a gazelor. Este numeric egală cu lucrul mecanic efectuat de un mol de un gaz ideal sub izobară încălzirea acestuia pentru 1 K.
Nu proces izobară
Graficul p (V) în cadrul procesului de muncă izobară este egală cu suprafața hașurate din figura 2, și dreptunghi.
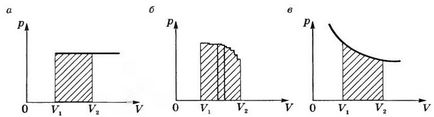
Dacă procesul este izobară (Fig. 2b), curba funcției p = f (V) poate fi reprezentat ca o linie întreruptă constând dintr-un mare număr isochors și isobars. Lucrările la secțiunile izocoră este zero, iar activitatea totală în toate domeniile vor fi egale izobară
A = \ lim_ \ sum ^ n_ p_i \ cdot \ Delta V_i \) sau \ (
A = \ int p (V) \ cdot dV \)
și anume Acesta va fi egală cu suprafața de figura umbrită.
Când procesul izoterma (T = const) muncă este egală cu suprafața formei hașurate prezentată în figura 2, în.
Se determină operație cu ajutorul formulei de mai sus, poate fi utilizat numai în cazul în care este cunoscut sub numele de presiune a gazului variază în funcție de volumul său, adică, formă cunoscută a funcției p = f (V).
Astfel, se observă că, chiar și cu aceeași modificare a volumului de lucru al gazului va depinde de procesul de tranziție (adică, de proces: izotermă, izobară, ...) de la starea inițială a gazului final. Prin urmare, putem concluziona că
- Munca in termodinamica este o funcție a procesului și nu este o funcție a statului.
Cantitatea de căldură
După cum se știe, atunci când forțele diverse procese mecanice schimbă W. energie mecanică măsoară schimbările din energia mecanică este de lucru aplicată sistemului:
În cazul în care transferul de căldură se modifică energia internă a corpului. Măsura de schimbare a energiei interne în sumă de schimb de căldură de căldură este.
Cantitatea de căldură - o măsură a schimbării interne de energie în procesul de schimb de căldură.
Astfel, atât activitatea și cantitatea de energie termică se caracterizează prin schimbare, dar nu identice cu energia internă. Ei nu caracterizează starea sistemului în sine (la fel ca energia internă), și de a determina tranziția de energie de la o formă la alta (de la un corp la altul), atunci când statul și, în esență, depinde de natura procesului.
Principala diferență între munca și cantitatea de căldură este faptul că
- lucrare descrie procesul de schimbare a energiei interne a sistemului, însoțit de conversie a energiei de la o formă la alta (din cauza mecanice interne);
- Cantitatea de căldură caracterizează un transfer intern de energie de la un corp la altul (de la un mai încălzit la mai puțin încălzită) nu este însoțită de transformări energetice.
Încălzire (răcire)
Experiența arată că cantitatea de căldură necesară pentru încălzirea m de masa corporala de la temperatura T1 la temperatura T2. Se calculează cu formula
Q = c \ cdot m \ cdot (T_2 - T_1) = c \ cdot m \ cdot \ Delta T \)
unde c - căldura specifică a substanței (valoarea tabelara);
Unitatea de căldura specifică la SI este joule per kilogram-Kelvin (J / (kg · K)).
teploemkostc specifică numeric egală cu cantitatea de căldură care trebuie să se acorde masa corporală de 1 kg, să-l încălzească până la 1 K.
De asemenea, luând în considerare căldura specifică și o valoare, cum ar fi capacitatea de caldura corpului.
Corpul specific de căldură C este numeric egală cu cantitatea de căldură necesară pentru modificări ale temperaturii corpului cu 1 K:
Căldura corporală unitate la SI este joule per Kelvin (J / K).
Vaporizarea (condensare)
Pentru conversia lichidului în vapori la o cantitate de căldură de temperatură constantă necesară pentru expend
în care L - căldura specifică a vaporizării (valoare tabelara). Condensarea aburului este eliberat aceeași cantitate de căldură.
Unitatea de căldura specifică a vaporizării este în SI jouli per kilogram (J / kg).
Topire (cristalizare)
Pentru a se topi cristalin masa m la temperatura de topire a corpului, corpul trebuie să raporteze cantitatea de căldură
Q = \ lambda \ cdot m, \)
unde λ - căldura de fuziune (valoare tabelara). aceeași cantitate de căldură este eliberată în timpul cristalizării corpului.
Unitatea de căldura specifică de topire este în SI jouli per kilogram (J / kg).
arderea combustibilului
Cantitatea de căldură care este eliberată în timpul arderii complete a combustibilului masa m.
în care q - căldura de combustie specifică (valoare tabelara).
Unitatea de căldura de combustie specifică este în SR jouli per kilogram (J / kg).