Cinetica reacțiilor enzimatice 1
cineticile enzimatice investighează efectul naturii chimice a substanțelor reactive (enzime, substraturi) și condițiile lor de interacțiune (concentrație, pH, temperatură, prezența activatorilor sau a inhibitorilor) rata reacției enzimatice. Viteza de reacție enzimatică (V) este măsurată prin scăderea sau creșterea cantității de produs de substrat per unitate de timp.
Când cataliză enzimatică, enzima (E) este reversibil conectat cu substratul (S), formând un complex tranzitorie enzimă-substrat (ES), care, la sfârșitul reacției, se descompune cu eliberarea enzimei (E) și produșii de reacție (F):
O caracteristică importantă a reacțiilor enzimatice - saturarea substratului enzimatic. La concentrații scăzute de substrat viteza de reacție este direct proporțională cu concentrația sa. Când ridicată - viteză de reacție maximă devine constantă și independentă de concentrația substratului [S] și este determinată în întregime de concentrația enzimei (Figura 11.).
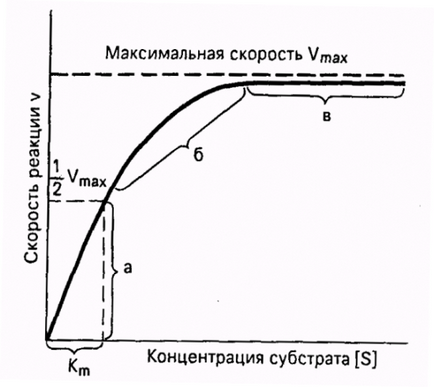
Fig. 11. Dependența vitezei de reacție enzimatică asupra concentrației substratului la o concentrație de enzimă constantă.
KS - constanta de disociere a ES complexe enzimatice substrat, constanta de echilibru inversa:
Cât este mai mică valoarea KS. cu cât afinitatea enzimei la substrat.
Relația cantitativă dintre concentrația substratului și vitezei de reacție enzimatică exprimă ecuația Michaelis-Menten:
,
u - viteza de reacție, Vmax - viteza maximă a unei reacții enzimatice.
Briggs și Haldane îmbunătățit ecuația introducând Michaelis KM constantă. determinată experimental.
Ecuația Briggs - Haldane:
Constanta Michaelis este numeric egală cu concentrația substratului (mol / l), la care viteza reacției enzimatice este jumătate din valoarea maximă (fig. 12). Km arată afinitatea enzimei la substrat; mai mică valoarea sa, cu atât mai mare afinitate.
Valorile experimentale ale Km pentru majoritatea reacțiilor enzimatice care implică un substrat este de obicei 10 -2 -10 -5 M. Dacă reacția este reversibilă, interacțiunea enzimei cu un substrat caracterizat prin reacția directă Km. este diferită de cea pentru substratul de reacție inversă.
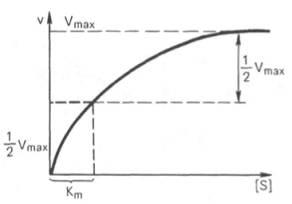
Fig. 12. Grafic opredeleniekonstanty Michaelis.
Enzime deosebesc de catalizatorii convenționali, un număr de proprietăți.
Termolabilității. sau sensibilitate la o creștere a temperaturii (fig. 13).
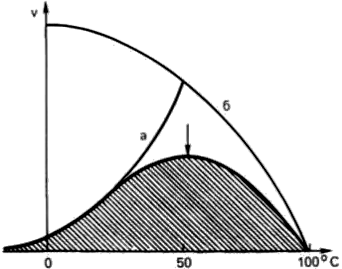
Fig. 13. Dependența de temperatură a vitezei de reacție enzimatică.
La o temperatură care să nu depășească 45-50 ° C, cele mai multe reacții biochimice crește rata de 2 ori când temperatura crește cu 10 ° C (în mod tipic van't Hoff). La temperaturi de peste 50 ° C, viteza de reacție începe să exercite o influență mare Denaturarea termică a proteinei enzimei care duce la o încetare completă a procesului de fermentație.
Temperatura la care activitatea catalitică a enzimei este maximă, se numește temperatura optimă. Temperatura optimă pentru majoritatea enzimelor de mamifere este la 37-40 ° C La temperaturi scăzute (0 ° C și mai jos), enzime, de obicei, nu colaps, cu toate că activitatea lor scade aproape de zero.
Dependența activității enzimei pH-ul mediului (Fig. 14).
există o valoare pH optim la care prezintă activitate maximă pentru fiecare enzimă. pH-ul optim al activității enzimatice constă într-o concentrație de ioni de hidrogen îngustă bandă, potrivite pentru țesuturile animale au lucrat în timpul evoluției valorilor fiziologice ale pH-ului 6,0-8,0. Excepțiile sunt pepsinei - 1,5-2,5; arginaza - 9.5-10.
Conform opiniilor actuale, efectul modificărilor pH-ului asupra moleculei de enzimă este expusă la structura terțiară a proteinei.
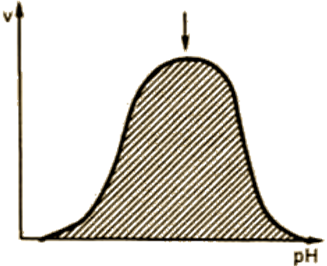
Fig. 14. Dependența vitezei de reacție enzimatică de pH.
Specificitatea. Înalta Specificitatea acțiunii datorită enzimelor conformaționale și complementaritatea electrostatica între moleculele substratului și enzimă și organizarea structurală unică a sitului activ, oferind o selectivitate a reacției.
specificitate absolută - sposobnostfermenta catalizeaza o singură reacție. De exemplu, ureazei catalizează reacția de hidroliză a ureei la NH3 și CO2.
Relativ (grup) specificitate - capacitatea enzimei de a cataliza grup de reacții de un anumit tip. specificitate relativă, de exemplu, enzimele hidrolitice posedă peptidaze hidrolizează legăturile peptidice în moleculele proteice și peptide.
specificitate stereochimică au enzime care catalizează conversia doar unul dintre regioizomerii. enzimă Fumarase catalizează conversia malat în numai fumarat izomerul trans și nu are nici un efect asupra izomerul cis al acidului maleic.
Înalta specificitate a acțiunii enzimei asigură un flux de anumite reacții chimice ale tuturor transformărilor posibile.