Cinetica enzimei - studopediya
Cataliza enzimatica este semnificativ diferit de non-enzimatice, și, prin urmare, cinetica reacțiilor enzimatice dezvoltate modele foarte speciale. Ele permit să se distingă cinetica de enzimă într-o secțiune separată de cinetica chimică, care a studiat dependența ratelor reacțiilor, catalizate de enzime, concentrația substanțelor reactive (enzime și substraturi), precum și condițiile interacțiunii lor (temperatură, pH-ul, concentrația
Coenzime și cofactori, prezența diferitelor efectoare: activatori și inhibitori).
Studiul cineticii acțiunii enzimatice este de mare importanță teoretică, pentru că numai din punctul de vedere al cineticii poate fi abordată pentru a aborda problema mecanismului de acțiune enzimatică. Dar este de asemenea necesar, dintr-o poziție practic, ca având doar anumite informații despre cinetica acțiunii unei anumite enzime, este posibil să se aleagă condiții optime de funcționare, precum și de a influența activitatea într-o anumită direcție, în diferite etape ale procesului.
Problemele legate de cinetica reacțiilor enzimatice, prezentate în detaliu în secțiunile relevante ale biochimiei și enzimologie, prin urmare, se concentrează pe acele poziții care sunt necesare pentru abordarea competenta de a lucra cu enzime: condițiile de selecție pentru determinarea activității enzimei, determinarea vitezei inițiale a reacției enzimatice, alegerea substratului, determinarea concentrației sale saturate, temperatura optima de acțiune și pH-ul, cofactori influență, activatori și inhibitori.
Prezența soluției de enzimă sau extractul poate fi determinată pe baza vitezei reacției catalizată de acestea, care poate fi estimată, fie prin acumularea produșilor de reacție sau prin pierderea de substrat.
Majoritatea reacției enzimatice sunt reacții de ordine mixte. (. Figura 8.1) Un curs curbă tipică a reacției enzimatice este după cum urmează:
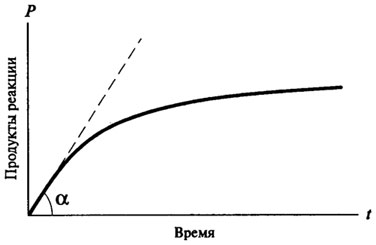
Fig. 8.1. Curba progresului timpului de reacție enzimatică
Astfel, în timp a reacției enzimatice nu poate fi descrisă printr-o ecuație matematică, ca și toate reacțiile enzimatice chiar la începutul apariției lor (atunci când există un exces de substrat și de produși de reacție mici formate) sunt
reacții de ordinul zero, și numai după ce dobândesc caracterul reacției primului sau al doilea ordin. reacție de ordinul zero, cu timpul nu se schimbă, dependența cantității de produs format din când în când este direct proporțională cu (vezi. fig. 8.2). Pentru reacțiile de viteză de reacție de ordinul întâi la un moment dat este proporțională cu concentrația de substrat disponibil și, în consecință, există o scădere constantă a vitezei de reacție în timp (vezi. Fig. 8.3).
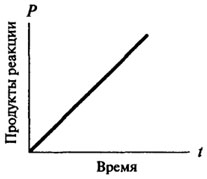
Fig. 8.2. Reprezentarea grafică a unei reacții de ordin zero
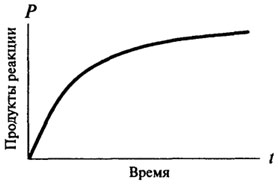
Fig. 8.3. O reprezentare grafică a unei prime reacții comandă
Pentru a determina în mod corect potențialul acestei enzime ca un catalizator, este necesar să se ia în considerare viteza reacției enzimatice, la un moment în care factorii încetinirea vitezei reacției enzimatice (lipsa de substrat, inhibarea specifică a produșilor de reacție, Denaturarea termică parțială a enzimei, etc.), Nu au timp pentru a arăta efectul său și există o relație direct proporțională între produsele de reacție și timpul.
Această viteză se numește viteza inițială a reacției enzimatice și este notat cu V0.
In practica V0 este determinată printr-o metodă grafică, care a construi curba pe parcursul timpului de reacție enzimatică. Viteza inițială este determinată ca panta tangentei trasată de la origine la cursul curbei reacției enzimatice (vezi. fig. 8.1).
Atunci când se lucrează cu o anumită enzimă, timpul de reacție trebuie să fie ales pe baza datelor experimentale privind viteza de reacție inițială.
În funcție de sarcina care se confruntă cercetătorii sau tehnologi, cei care lucrează cu enzime, pentru a alege una sau alta abordare în această lucrare. Aceasta se referă la următoarele.
1. Dacă este necesar să se izoleze și caracterizarea enzimei oricărui obiect biologic, materii prime alimentare, să aplice orice alt sistem de separare și purificare cunoscută, sau de a dezvolta o schemă optimă pentru enzima prin variația și testarea diferitelor combinații de etape de bază pentru purificarea și izolarea enzime (proteine): extracția, precipitarea diferitelor moduri, cromatografie pe gel sau alte metode bazate pe diferențele în caracteristicile fizico-chimice ale enzimelor specifice (vezi. de asemenea, cap. 2). La fiecare etapă de separare și purificare a preparatului enzimatic trebuie să fie caracterizate pentru activitatea enzimatică și conținutul de proteină. În acest caz, determinarea activității enzimatice (determinarea F0) este realizată utilizând un substrat standard de; identifica pH-ul și temperatura optimă. Încă studii suplimentare efectuate la saturarea concentrație de substrat, pH și temperatură optimă. Studiul efectului activatorilor și inhibitorilor specifici permite, în acest caz, pentru a obține informații valoroase despre structura site-ului activ și posibilul mecanism al acțiunii catalitice. Este necesar să se sublinieze importanța unei abordări metodice aprofundate atunci când se lucrează cu enzime. ar trebui să precupeți nici un timp și efort pentru a alege modul de extracție (durata, temperatura, agent de extracție, tipul de extracție - exhaustivă sau nu), alegerea metodelor de determinare a activității, rafinamentul și posibila modificare a acestui obiect particular de studiu; În plus, lucrează cu diferite enzime de puritate are, de asemenea, propriile sale caracteristici, propria sa specificitate: ei au un pH diferit și stabilitate termică și, în plus, pot răspunde diferit la impactul diferitelor factori.
2. În cazul în care sarcina este de a determina modul în care se va comporta enzimă activă (preparatul enzimatic), într-un anumit mod considerat tehnologie alimentară, este necesar să se efectueze o acțiune enzimatică de cercetare în condițiile acestui proces (concentrația substratului, durata, pH, temperatură, umiditate), pentru a explora efectul diferitelor componente alimentare și materiile prime folosite aditivi in activitatea enzimei, în scopul de a determina posibilitatea și modalități de a influența procesul de fermentație într-un ghid dorit NII.
Considerăm acum factorii care influențează viteza reacțiilor enzimatice.
Efectul concentrației substratului asupra vitezei reacției enzimatice. Concentrația de substrat este un factor important în determinarea ratei reacției enzimatice. Înapoi în 1902. W. Henry în studiul hidrolizei enzimatice a zaharozei sugerat că enzima p-fructofuranosidase interacționează cu substratul său și apoi această
compus se descompune, enzima rămâne în forma originală, iar zaharoza substrat este clivat în glucoză și fructoză.
Această propunere a fost dezvoltată de L. Michaelis și M. Menten. In 1913, ei au postulat următoarea ecuație reacției enzimatice:
unde k + 1 - constanta vitezei de reacție pentru formarea complexului ES, k-1, k + 2 - constantele vitezei de reacție pentru descompunerea ES complexe în două direcții.
Apoi Ks - constanta de disociere a complexului ES este raportul invers și vitezele de reacție constantă înainte:
Sursa multor neînțelegeri în trecut și în prezent, este utilizarea incorectă a termenului „Michaelis constantă“ și două Ks și caractere Km pentru a reprezenta valori non-identice, la toate, în ciuda recomandării foarte clară a Comisiei Enzyme a Uniunii Internaționale de Biochimie. Prima valoare -Ks - constanta de echilibru, exprimată prin raportul Ks =
Ea caracterizează afinitatea enzimei la substrat (sau, alternativ, ES rezistență complex), în care există o proporționalitate inversă între mărimea Ks și afinitatea enzimei la substrat. A doua valoare este concentrația substratului -km corespunzătoare la care V = Vmax / 2. Adesea Ks proprietate atribuite eronat Km. Ha adevărat Km va fi o măsură a afinității enzimei la substrat numai într-un singur caz, când valoarea lui k + 2 este atât de mic încât aproape coincide cu Km Ks.
Multe enzime catalizează reacții care implică două substraturi. Așa-numitele reacții bimoleculară includ grupe chimice de transfer de reacții de la un compus la altul, reacția de sinteză, reacție redox.
Astfel de reacții pot avea loc prin două mecanisme diferite. În reacțiile de primul tip, numite reacții de substituție singulară, două substraturi A și forma B un complex enzimatic EAB, care apoi se descompune pentru a forma produse de reacție C și D. Reacția dvuhsubstratnyh doilea tip se desfășoară conform mecanismului de substituție dublă (mecanism de „ping-pong“) . În aceste reacții, cu centrul activ al enzimei la fiecare moment de timp asociat cu doar una dintre cele două substraturi.
In studiul cineticii reacțiilor bimoleculară, concentrația unuia dintre substraturi este constantă stânga (B), iar al doilea - în schimbare (A). În acest caz, 1 / V coordonatele 1 / [A] poate fi preparat "aparent" valoarea K t. Valoarea true Vmax și K B m este obținută în studiul mai multor concentrații de W. substrat In mod similar, atunci când se determină primit K A m (când concentrația A este constantă, și variază în concentrație). Rm în ceea ce privește diferitele substraturi în aceeași reacție, pot fi diferite - aceasta se vede clar din exemplul următor.
Reacția catalizată de alcool dehidrogenază:
etanol acetaldehida
Valoarea Km pentru alcool dehidrogenază de drojdie: