Prima lege a termodinamicii
Primul pornire (prima lege) lege a termodinamicii - este legea de conservare și de transformare a energiei unui sistem termodinamic.
Conform primei legi a termodinamicii, munca poate fi realizată numai de căldură sau de o altă formă de energie. În consecință, funcționarea și cantitatea de căldură a fost măsurată în aceleași unități - jouli (și energie).
Prima lege a termodinamicii a fost formulată de savantul german Yu L. Mayer în 1842 și confirmată experimental de savantul englez John. Joel în 1843
Prima lege a termodinamicii este formulat după cum urmează:
Schimbarea în energie internă a sistemului în timpul tranziției de la un stat la altul este egală cu suma forțelor externe și cantitatea de căldură. sistemul de transport:
în care AU - modificarea energiei interne, A - muncă forțe externe, Q - cantitatea de căldură transferată către sistem.
De la (A + = AU Q) urmează legea conservării energiei interne. Dacă sistemul este izolat de influențe externe, atunci A = 0 și Q = 0. și deci = 0 DU.
În cazul în care orice procese care au loc într-un sistem izolat, energia internă rămâne constantă.
Dacă sistemul nu funcționează, mai degrabă decât o forță externă, atunci ecuația (= A + AU Q) este scris ca:
,
în care A '- lucrările efectuate de către sistem (A' = -A).
Cantitatea de căldură transferată în sistem, există o schimbare în energia sa internă și pentru a face sistemul să funcționeze pe organisme externe.
Prima lege a termodinamicii poate fi formulată ca imposibilitatea de mișcare perpetuă a primului tip care au efectuat muncă fără tragere de energie din orice sursă (adică. E. Numai în detrimentul energiei interne).
căldură Într-adevăr, în cazul în care organismul nu este furnizat (Q- 0), funcționarea A“. conform ecuației, se realizează numai în detrimentul pierderii interne de energie A „= -δU. După alimentarea cu energie electrică va fi epuizate, motorul se oprește de lucru.
Trebuie amintit că, în calitate de lucru. și cantitatea de căldură, sunt caracteristici ale schimbării în energie internă a procesului, astfel încât să nu se poate spune că sistemul conține o anumită cantitate de căldură sau de muncă. Sistemul are doar o anumită energie internă, în orice stare.
Aplicarea primei legi a termodinamicii la diferite procese.
Luați în considerare aplicarea primei legi a termodinamicii la diferite procese termodinamice.
proces izocoră.
Funcția p (T), pe o diagrama termodinamic descrisă isochore.

Izocoră (izocoră) proces - proces termodinamic care apar în sistem la volum constant.
proces izocoră poate fi realizată în gaze și lichide închise într-un vas cu volum constant.
Când volumul de gaz de proces izocoră nu se schimbă (0 = Av), și, în conformitate cu prima lege a termodinamicii,
t. e. schimbare în energia internă este egală cu cantitatea de căldură transferată, t. k. lucrarea (A = rδV = 0) gazul nu este efectuată.
În cazul în care gazul este încălzit, apoi Q> 0 și DU> 0. creșterile sale interne de energie. La gazul de răcire Q <0 и δU <0. внутренняя энергия уменьшается.
proces izotermic.
proces izotermic Izoterma grafic.

proces izoterm - un proces termodinamic care apar în sistem la o temperatură constantă.
. Ca proces izoterm energia internă a gazului nu este schimbat, vezi formula (T = const), atunci toate cantitatea de gaz transmis de căldură merge la operațiunea de notare:
La primirea gazului de căldură (Q> 0), se efectuează de lucru (A „> 0). În cazul în care gazul cedează căldură în mediul Q <0 и A' <0. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой p(V) .

proces izobară.
Gibbs proces termodinamic diagrama ilustrat isobars.

Gibbs (izobară) proces - proces termodinamic care apar în sistem cu presiune constantă p.
Exemple de proces izobară este extinderea gaz din cilindru cu piston, care mers încărcate liber.
Când procesul izobară, conform formulei, cantitatea de căldură transmisă gazului este de a schimba energia sa internă și comiterea unei operațiuni AU A „la o presiune constantă:
Angajarea unui gaz ideal este determinată dintr-un teren de p (V) pentru un proces izobară (A „= pδV).
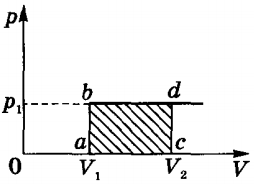
Pentru un gaz ideal sub volumul procesului izobară proporțională cu temperatura. în gazele reale ale căldurii consumate într-o schimbare în energia medie a particulelor de interacțiune.
proces adiabatic.
proces adiabatic (un proces adiabatic) - este procesul termodinamic producera în sistem fără schimb de căldură cu mediul (Q = 0).
Sistemul de izolație adiabatic se realizează aproximativ o navă Dewar, în membranele adiabatice așa-numitele. Pe sistemul izolat adiabatic nu afectează modificarea temperaturii corpurilor din jur. Energia sa internă U poate fi modificat numai prin activitatea desfășurată de organisme externe asupra sistemului, sau sistemul în sine.
Conform primei legi a termodinamicii (= A + AU Q), în sistemul adiabatic
unde A - lucru de forțe externe.
Când expansiunea adiabatică a gazului A <0. Следовательно,
,
înseamnă că scăderea temperaturii sub expansiune adiabatică. Aceasta conduce la faptul că presiunea gazului este redusă mult mai puternic decât în procesul de izoterme. Figura 1-2 de mai jos adiabatic care se extinde între două izoterme ilustrează grafic acest lucru. Aria de sub adiabatică numeric egală cu lucrul mecanic efectuat de gaz în timpul expansiunii sale adiabatică a V1 volum. V2.
compresie adiabatică conduce la o creștere a temperaturii gazului, adică a coliziunilor elastice ale moleculelor de gaz cu piston medii crește cu energie cinetică, în contrast cu extensia atunci când aceasta scade (în primul caz, viteza moleculelor de gaz crește, în al doilea - a redus) ...
Abrupt încălzirea aerului în compresie adiabatică utilizate la motoarele Diesel.
Ecuația bilanțului termic.
În schimbarea sistemului termodinamic închis (izolat din corpurile exterioare) a energiei interne a unui sistem de corp δU1 nu poate conduce la o modificare a energiei interne a întregului sistem. Prin urmare,
Dacă în interiorul sistemului nu face nici o lucrare nici un cadavru, apoi, în conformitate cu prima lege a termodinamicii, variația energiei interne a unui organism are loc numai prin schimbul de căldură cu celelalte organisme ale sistemului: δUi = Qi. Luând în considerare, obținem:
,
Această ecuație se numește ecuația de echilibru termic. Există Qi - numărul de căldură. primite sau eliminate i -lea organism. Oricare dintre cantitățile de căldură poate însemna Qi căldura generată sau absorbită în timpul topirii unui corp, ardere, evaporarea sau condensarea vaporilor, aceste procese au loc în cazul în diferite organe ale sistemului și va determina raportul adecvat.
Ecuația de echilibru de căldură este o expresie matematică a legii conservării energiei în timpul schimbului de căldură.