procese termodinamice gaze ideale
Caracteristicile principalelor tipuri de procese termodinamice ale gazelor ideale cu modificări ale parametrilor, cum ar fi temperatura, volumul, presiunea și munca gazelor produse.
Tipuri de procese. Principalele procese in termodinamica de inginerie, foarte importante atât teoretic, cât și aplicate metode, sunt:
Helmholtz - curge la volum constant;
izobară - care curge la presiune constantă;
izoterma - care curge la o temperatură constantă;
adiabatică - la care nu există nici un schimb de căldură cu mediul;
politropic - satisfacerea pv ecuația n = const.
Primele patru procese sunt cazuri speciale ale procesului de politropice.
In studiul acestor procese este determinat în ecuația procesului coordonatele p, v și T, s, comunicarea dintre parametrii de stare a gazelor, măsurarea energiei interne, amploarea lucrărilor externe și cantitatea de căldură captată.
proces izocoră. Când starea de proces izocoră dv = 0 sau v = const. ecuația gazului ideal care
și anume Presiune gaz este direct proporțională cu temperatura absolută:
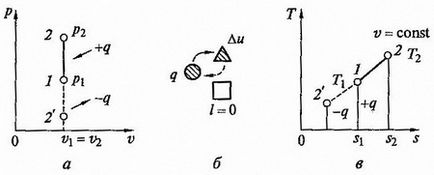
Fig. 2.4 proces izocoră la p - v și T - s diagrame (a, c) și energia circuitului echilibru (b)
Diagrame de proces la p - v și T - s - diagrame, precum și circuitul echilibru energetic prezentat în Fig. expansiune Activitatea în acest proces este zero, deoarece dv = 0. Cantitatea de căldură furnizată fluidului de lucru în perioada 1 - 2 cv = const. determinată de raportul
Deoarece l = 0. atunci, în conformitate cu prima lege a termodinamicii
proces izobară. Numitului proces izobară care are loc la presiune constantă. Din ecuația de gaz ideal de stat, atunci când p = const găsi
și anume în volumul izobară de gaz de proces proporțională cu temperatura absolută (legea Gay-Lussac a) acestuia. Diagrame de proces la p - v și T - s - diagrame și ttakzhe diagrama znergoballansa prezentată în Fig. 2.5.
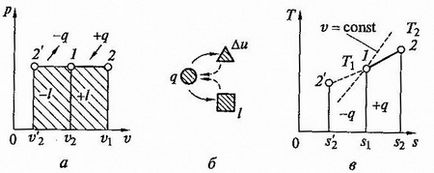
Figura 2.5. proces izobară la p - v și T - s - diagrame (a, c) și energia circuitului echilibru (b)
Cantitatea de căldură transmisă la gaz la încălzire (sau sub răcire pentru a le da), se găsește din ecuația
proces izotermic. La constantă proces temperatură izotermă, prin urmare, pv = RT = const sau p2 / p1 = v1 / v2. și anume presiune și volum sunt invers proporționale între ele, astfel încât o comprimare izotermă a crește presiunea gazului, iar în timpul expansiunii - cade (Boyle - Mariotte).
Graful proces izoterm în coordonate p, v (Fig.2.6, a) este o hiperbolă isoscel, pentru care axele de coordonate sunt asimptomami.
Deoarece energia nu se schimbă, atunci energia internă a unui gaz ideal în proces rămâne constantă (= 0 DU) și toată căldura furnizată gazul este complet transformată în expansiune de lucru q = l.
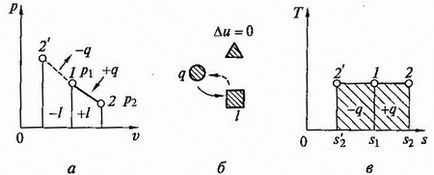
Fig. 2.6. proces izoterm p - v și T - s - diagrame (a, c) și circuitul echilibru energetic (b)
Pentru comprimarea izotermă a căldurii gazului este îndepărtată într-o cantitate egală cu costul lucrărilor de compresie. Schema și graficul bilanțului energetic și -s proces T izobare - diagrama prezentată în Fig. 2.6, b, c.
proces adiabatic. Proces numit schimbări adiabatice în stare de gaz, care are loc fără schimb de căldură cu mediul înconjurător. Acest proces corespunde cazului când containerul sau plicul care închide un gaz, izolat termic de mediul înconjurător. Pentru această ecuație caz de prima lege a termodinamicii, deoarece usloviyudq = 0 pe ia forma
Acest lucru înseamnă că, în procesul de lucru expansiune adiabatică se face numai cheltuind o energie internă a gazului și că comprimarea care are loc prin acțiunea forțelor externe, toată munca se face de ei pentru a crește energia internă a gazului.
Notăm căldura specifică într-un proces adiabatic prin grădină și condiția expresă du = 0, după cum urmează:
Această condiție indică faptul că căldura specifică în procesul adiabatic este egal cu zero, adică, Garden = 0. Este cunoscut faptul că
Ecuația procesului curba adiabatică (adiabatică) în coordonate p, v (Fig.2.7 a) are forma
unde k - se numește indicele adiabatic (această valoare este, de asemenea, numit raportul Poisson).
și anume lucru tehnic proces de expansiune adiabatică este egală cu diferența de entalpie la începutul și sfârșitul procesului.
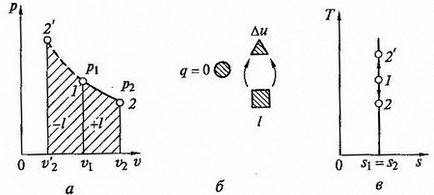
Fig.2.7 Adiabptny proces p - v și T - s liagrammah (a, c) și energia circuitului echilibru (b)
proces adiabatic are loc fără frecare internă în fluidul de lucru, se numește isentropic. La diagrama T -s (figura 2.7, c) este reprezentat printr-o linie verticală.
De obicei, procesele reale adiabatic au loc în prezența frecării interne în fluidul de lucru, prin care căldura este întotdeauna eliberată, care imediat a raportat la fluidul de lucru. În acest caz, DS> 0, procesul este numit proces adiabatic actuale.
proces Polytropic și valoarea generalizator. Numitului proces politropic, care are loc la o capacitate de căldură constantă și este descrisă de ecuația
Polytropic exponent n poate lua orice valoare numerică în intervalul de la -∞ la + ∞, dar este constantă pentru un proces dat.
Din ecuația (2.13) și ecuația Clapeyron este ușor de a obține expresii corelând fotovoltaică și T la oricare două puncte de pe politropic:
proces Polytropic este o generalizare a valorii pentru acoperirea totalitatea proceselor termodinamice de bază.