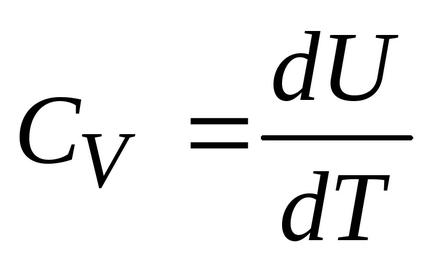proces izocoră
proces izocoră are loc la volum constant. Presiunea asupra dependența de temperatură este descrisă de ecuația:
care prevede: pentru o masă dată de gaz la o presiune constantă a volumului de gaz crește liniar cu creșterea temperaturii.
proces izobară
proces izobară. Acest proces are loc la presiune constantă, P = const.
Dependența volumului de temperatură este descris de:
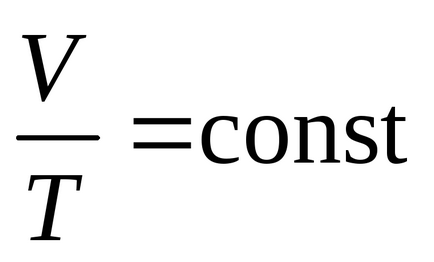
care prevede: pentru o masă dată de gaz la o presiune constantă a volumului de gaz crește liniar cu creșterea temperaturii.
proces adiabatic
proces adiabatic este un proces care are loc fără nici un schimb de căldură cu mediul (dQ = 0). Acesta este descris de ecuația Poisson:
unde este un proces adiabatic constant. proces adiabatic continuă este egal cu:
Într-un gaz de proces adiabatic schimba toți parametrii: presiune, volum și temperatură.
2. Capacitatea termică a gazelor
Cantitatea de căldură dQ, raportată organismul prin încălzire, precum și
,
unde c - căldura specifică a substanței. egală cu cantitatea de căldură transmisă la o unitate de masă de material pentru a încălzi într-un grad.
În plus, introducem conceptul de capacitate specifică de căldură molară de căldură. Molar specific de căldură C - egală cu cantitatea de căldură transmisă la un mol de substanță să se încălzească la un anumit grad.
Molar căldura specifică și sunt legate de:
unde C este capacitatea calorică molară, - masa molară.
Gazul poate fi încălzit la o presiune constantă și la volum constant, capacitatea calorică a gazului astfel încât cele două sunt introduse: izobară și izocoră. Molar Capacitatea izobară și izocoră căldura molară a gazului asociat cu relațiile respective:
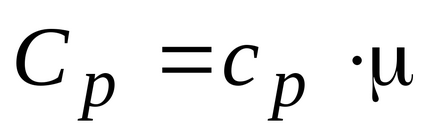
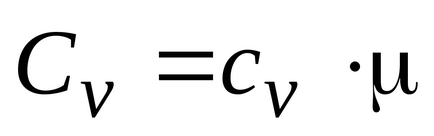
Acest lucru arată că raportul molar dintre călduri specifice ale gazului este raportul specific
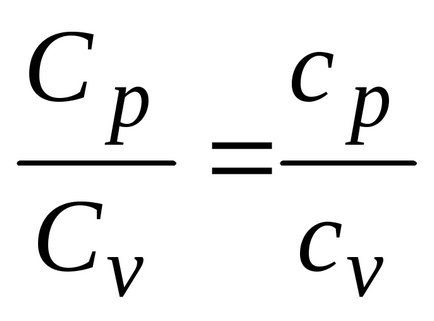
Cantitatea de căldură transmisă la 1 mol de gaz la proces izocoră este:
și la procesul de izobară
3 Prima lege a termodinamicii
Cantitatea de căldură dQ. a raportat un sistem termodinamic, este cheltuit pe creșterea dU și munca sistemului său intern de energie dA împotriva forțelor externe.
Energia internă a U - energia totală a tuturor moleculelor din gazul este gaz ideal - energia cinetică a mișcării de rotație și de translație. Pentru un mol de gaz este determinat de expresia
Activitatea desfășurată de gaz egal
în cazul în care dV - schimbarea volumul său.
Aplicarea primei legi a termodinamicii proceselor izoterme
In acest proces, temperatura rămâne constantă (T = const), în acest caz, dT = 0 și energia internă nu se schimbă dU = 0 dQ = dA, adică întregul gaz de intrare de căldură este consumată pentru a efectua munca împotriva forțelor externe.
proces izocoră
Când procesul de izocoră V = const, dV = 0 și dA = 0. Ie în care operația de proces nu se realizează, ca Volumul nu este schimbat. Apoi, 1 început este scris:
Ie cantitatea de căldură consumată cu privire la modificarea energiei interne. Dar, prin definiție,
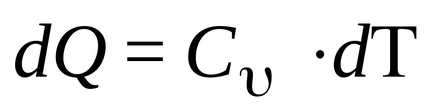
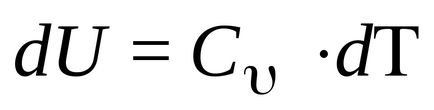
Această formulă arată că variația energiei interne a gazului este determinată de doar o modificare a temperaturii acestuia. Capacitatea de căldură la volum constant (capacitatea calorică izocoră) este egală cu: